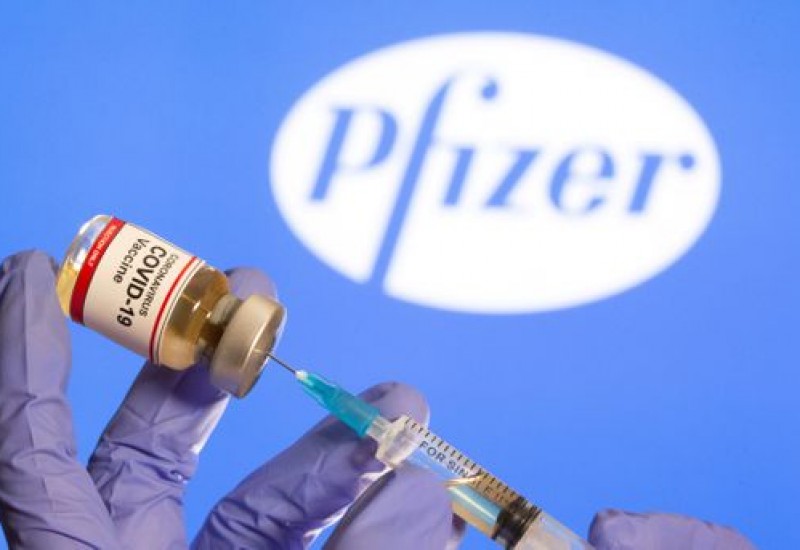
A farmacêutica
americana Pfizer e a empresa de biotecnologia alemã BioNTech entraram nesta
sexta-feira, 20, com o pedido de uso emergencial da vacina contra a covid-19 na
agência regulatória de medicamentos e alimentos dos EUA (FDA). Na última
semana, as empresas anunciaram que os resultados finais dos testes do
imunizante apontaram eficácia de 95% do produto na proteção contra a infecção
pelo coronavírus.
"É com grande
orgulho e alegria - e até mesmo um pouco de alívio - que posso dizer que nosso
pedido de autorização de uso emergencial para nossa potencial vacina está agora
nas mãos do FDA. Este é um dia histórico para a ciência. Demorou apenas 248
dias desde o dia em que anunciamos nossos planos de colaborar com a BioNTech
até a data de apresentação à FDA. Operamos com velocidade extraordinária em
nosso programa de desenvolvimento clínico", declarou ontem o CEO da
Pfizer, Albert Bourla.
Em comunicado
conjunto, as companhias afirmaram que estarão prontas a distribuir o produto
"dentro de horas" após a autorização. A expectativa das empresas é de
que a vacinação comece nos Estados Unidos entre o meio e o fim de dezembro.
Após receber o
pedido, a FDA informou que agendou para o dia 10 de dezembro uma reunião com
seu comitê assessor para vacinas e produtos biológicos na qual será discutida
se o produto receberá ou não o aval do órgão. Até lá, os especialistas da
agência passarão as próximas semana analisando os dados do estudo submetidos
pelas farmacêuticas.
A Pfizer e a
BioNTech disseram ainda que já iniciaram o processo de submissão contínua de
resultados dos estudos nas agências regulatórias da Europa, Austrália, Canadá,
Japão e Reino Unido e pretendem submeter os documentos para outras autoridades
regulatórias do mundo imediatamente.
A submissão
contínua ocorre quando os resultados das fases dos testes clínicos vão sendo
apresentados a medida que ficam prontos e não somente ao final da pesquisa. A
prática acelera a análise dos dados por parte das agências.
Anvisa
Não há informação
sobre quando a solicitação de registro será feita à Agência Nacional de
Vigilância Sanitária (Anvisa). Procurada pelo Estadão, a agência disse que não
recebeu "pedidos da Pfizer para registro ou submissão continua de etapas
já realizadas para a sua vacina contra a covid-19".
Importante lembrar
que a Anvisa, ao contrário da FDA, não emite autorização de uso emergencial
para produtos. Mas se os resultados dos estudos forem robustos o suficiente
para comprovar eficácia e segurança, a agência poderá conceder o registro
regular à vacina.
Também questionada
pela reportagem, a representação da Pfizer no Brasil não informou quando esse
pedido será submetido às autoridades brasileiras. Anteriormente, a empresa
afirmou que apresentou ao Ministério da Saúde uma proposta de fornecimento, no
primeiro semestre de 2021, de doses suficientes para vacinar "alguns
milhões" de brasileiros. O número exato não foi informado.
As empresas
disseram estar trabalhando para escalar a produção, na expectativa de chegar a
50 milhões de doses - suficientes para imunizar 25 milhões de pessoas - até o
fim do ano, e a 1,3 bilhão de doses em 2021.
Segurança
De acordo com as
farmacêuticas, o pedido de registro na agência americana é apoiado pelos dados
que demonstraram 95% de eficácia e por dados de segurança exigidos pela FDA,
como o acompanhamento de cerca de 38 mil participantes por dois meses após a
segunda dose da vacina.
"O envio
também inclui dados de segurança solicitados em aproximadamente cem crianças de
12 a 15 anos de idade. Aproximadamente 42% dos participantes globais e 30% dos
participantes dos EUA no estudo de fase 3 têm origens racial e etnicamente
diversas, e 41% dos participantes globais e 45% dos participantes dos EUA têm
56-85 anos de idade. Até o momento, o Comitê de Monitoramento de Dados (DMC)
para o estudo não relatou nenhuma preocupação séria de segurança relacionada à
vacina", destacou o comunicado das empresas.
>>>Clique e receba notícias do JRTV Jornal Regional diariamente em seu WhatsApp.
-
 18/04/2024 - 01h45
18/04/2024 - 01h45 -
 18/04/2024 - 01h34
18/04/2024 - 01h34 -
 18/04/2024 - 01h26
18/04/2024 - 01h26 -
 17/04/2024 - 16h30
17/04/2024 - 16h30 -
 17/04/2024 - 16h07
17/04/2024 - 16h07 -
 17/04/2024 - 02h47
17/04/2024 - 02h47 -
 17/04/2024 - 00h22
17/04/2024 - 00h22
-
 03/11/2020 - 19h42
03/11/2020 - 19h42 -
 11/05/2020 - 10h19
11/05/2020 - 10h19 -
 15/12/2021 - 09h59
15/12/2021 - 09h59 -
 30/05/2019 - 14h42
30/05/2019 - 14h42 -
 10/01/2022 - 11h36
10/01/2022 - 11h36 -
 04/05/2021 - 12h59
04/05/2021 - 12h59 -
 21/01/2022 - 09h23
21/01/2022 - 09h23









DEIXE UM COMENTÁRIO
Facebook