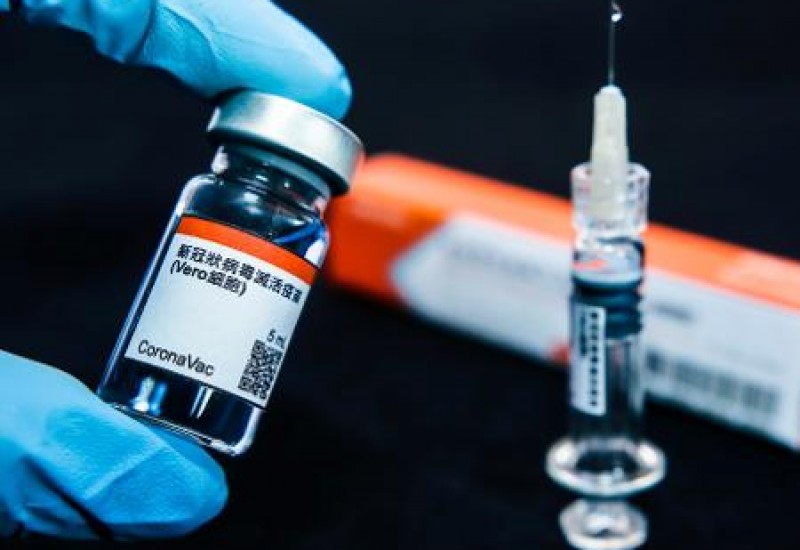
A Agência Nacional
de Vigilância Sanitária (Anvisa) determinou a interrupção do estudo clínico da
vacina CoronaVac. Isso devido uma ocorrência de um evento adverso grave, que
aconteceu no dia 29/10. Desta forma, ficou decidido pela interrupção do estudo
para avaliar os dados observados até o momento e julgar o risco/benefício da
continuidade do estudo. Esse tipo de interrupção é previsto pelas normas da
Anvisa e faz parte dos procedimentos de Boas Práticas Clínicas esperadas para
estudos clínicos conduzidos no Brasil.
Com a interrupção
do estudo, nenhum novo voluntário poderá ser vacinado. A Anvisa reitera que,
segundo regulamentos nacionais e internacionais de Boas Práticas Clínicas, os
dados sobre voluntários de pesquisas clínicas devem ser mantidos em sigilo, em
conformidade com princípios de confidencialidade, dignidade humana e proteção
dos participantes.
Além disso, a
Anvisa informou que apesar das notícias promissoras divulgadas por laboratórios
farmacêuticos em busca de uma imunização eficiente contra a Covid-19, até o
momento não existem dados para a avaliação da eficácia e da segurança destes
produtos. Desta forma, não é possível antecipar posições sobre a eficácia e a
segurança das vacinas antes que as pesquisas sejas concluídas e os dados
analisados. Todas as quatro vacinas para Covid-19 em teste no país encontram-se
na fase 3 de pesquisa e ainda não há resultados conclusivos para nenhum dos
produtos.
-
 29/11/2024 - 02h19
29/11/2024 - 02h19 -
 29/11/2024 - 02h15
29/11/2024 - 02h15 -
 29/11/2024 - 02h07
29/11/2024 - 02h07 -
 29/11/2024 - 02h07
29/11/2024 - 02h07 -
 29/11/2024 - 02h03
29/11/2024 - 02h03 -
 29/11/2024 - 01h43
29/11/2024 - 01h43 -
 28/11/2024 - 15h39
28/11/2024 - 15h39
-
 03/11/2020 - 19h42
03/11/2020 - 19h42 -
 11/05/2020 - 10h19
11/05/2020 - 10h19 -
 15/12/2021 - 09h59
15/12/2021 - 09h59 -
 30/05/2019 - 14h42
30/05/2019 - 14h42 -
 10/01/2022 - 11h36
10/01/2022 - 11h36 -
 04/05/2021 - 12h59
04/05/2021 - 12h59 -
 21/01/2022 - 09h23
21/01/2022 - 09h23









DEIXE UM COMENTÁRIO
Facebook